Modelo Atômico de Thomson – Definição, Características e Fundamentos: o modelo proposto por J.J. Thomson, no início do século XX, revolucionou a compreensão da estrutura atômica. Antes de Thomson, o átomo era considerado uma esfera maciça e indivisível, conforme o modelo de Dalton. A descoberta do elétron, contudo, impulsionou uma nova perspectiva, levando Thomson a propor um modelo que considerava o átomo como uma esfera de carga positiva com elétrons dispersos, semelhante a um “pudim de passas”.
Este trabalho analisará a definição, características e fundamentos desse modelo crucial na história da física.
A influência da descoberta do elétron foi fundamental para a formulação do modelo de Thomson. A capacidade de desviar raios catódicos por campos elétricos e magnéticos indicava a existência de partículas carregadas negativamente dentro dos átomos, contradizendo a ideia de indivisibilidade atômica. O modelo de Thomson, embora posteriormente substituído, representou um passo significativo na compreensão da natureza elétrica da matéria e abriu caminho para modelos mais sofisticados, como o modelo nuclear de Rutherford.
Definição do Modelo Atômico de Thomson
O modelo atômico proposto por J.J. Thomson em 1904, também conhecido como modelo do “pudim de passas”, representou um avanço significativo na compreensão da estrutura atômica, superando a visão puramente indivisível do átomo de Dalton. Este modelo surge após a descoberta do elétron, revolucionando a ideia de um átomo maciço e homogêneo.
Características do Modelo de Thomson
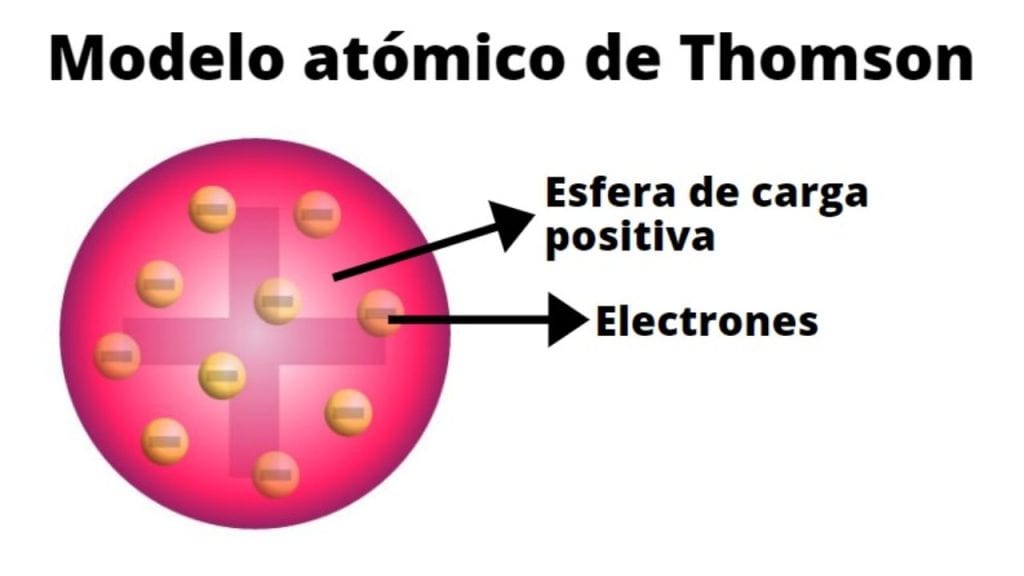
Thomson propôs que o átomo era uma esfera de carga positiva, com elétrons de carga negativa incrustados nela, como passas em um pudim. A carga positiva e a carga negativa se distribuíam uniformemente, resultando em um átomo eletricamente neutro. A massa do átomo era considerada distribuída uniformemente por toda a esfera. Essa distribuição de cargas explicava a neutralidade elétrica observada nos átomos.
A quantidade de elétrons incrustados na esfera positiva determinava as propriedades químicas do elemento.
Comparação com Modelos Anteriores
O modelo de Thomson difere significativamente do modelo atômico de Dalton, que descrevia o átomo como uma esfera maciça, indivisível e indestrutível, sem estrutura interna. A principal diferença reside na incorporação de partículas subatômicas (elétrons) no modelo de Thomson, refutando a ideia de indivisibilidade atômica proposta por Dalton. O modelo de Thomson, portanto, introduziu a primeira concepção de uma estrutura interna para o átomo.
Influência da Descoberta do Elétron, Modelo Atômico De Thomson – Definição, Características E Fundamentos
A descoberta do elétron por Thomson em 1897 foi fundamental para a formulação do seu modelo atômico. A evidência experimental da existência de partículas subatômicas carregadas negativamente forçou uma revisão radical do modelo atômico de Dalton. Thomson, tendo descoberto o elétron, precisou explicar a presença dessas partículas carregadas negativamente em um átomo que, como um todo, era eletricamente neutro.
Essa necessidade levou à proposição da esfera de carga positiva que equilibrava a carga negativa dos elétrons.
Limitações do Modelo de Thomson
Apesar de seu avanço, o modelo de Thomson apresentava limitações significativas. Ele não conseguia explicar a dispersão de partículas alfa em experimentos como o de Geiger-Marsden (experimento da folha de ouro), que posteriormente levaria à proposição do modelo nuclear de Rutherford. O modelo de Thomson não conseguia explicar a natureza discreta dos espectros de emissão atômica, nem a estabilidade dos átomos.
A distribuição uniforme da carga positiva não podia justificar os resultados experimentais que indicavam uma concentração de carga positiva em uma região muito menor do que o átomo como um todo.
Comparação entre os Modelos de Thomson e Dalton
| Nome do Modelo | Descrição do Átomo | Principais Características | Limitações |
|---|---|---|---|
| Modelo de Dalton | Esfera maciça, indivisível e indestrutível. | Átomo como partícula fundamental e homogênea; todos os átomos de um mesmo elemento são idênticos. | Não explica a existência de partículas subatômicas; não explica as diferentes propriedades químicas dos elementos. |
| Modelo de Thomson | Esfera de carga positiva com elétrons incrustados (“pudim de passas”). | Átomo como uma esfera com carga positiva e elétrons negativos; átomos são eletricamente neutros. | Não explica a dispersão de partículas alfa; não explica os espectros de emissão atômica; não explica a estabilidade atômica. |
Características do Modelo Atômico de Thomson
O modelo atômico proposto por J.J. Thomson, também conhecido como modelo do “pudim de passas”, apresenta características distintas que o diferenciam dos modelos atômicos anteriores e posteriores. Sua principal inovação reside na introdução da ideia de que o átomo não é uma esfera maciça e indivisível, mas sim uma estrutura com componentes subatômicos.
Distribuição de Cargas Elétricas no Modelo Atômico de Thomson
No modelo de Thomson, o átomo é representado como uma esfera de carga elétrica positiva, na qual estão incrustadas partículas de carga negativa, os elétrons. A analogia com um pudim de passas, onde as passas representam os elétrons e a massa do pudim a carga positiva, ilustra essa distribuição. A carga positiva é difusa e uniformemente distribuída por toda a esfera, enquanto os elétrons estão dispersos nessa matriz positiva.
A quantidade de carga positiva é igual à quantidade de carga negativa, garantindo a neutralidade elétrica do átomo.
Neutralidade Elétrica dos Átomos no Modelo de Thomson
A neutralidade elétrica dos átomos é uma característica fundamental do modelo de Thomson. A igualdade entre a carga positiva da esfera e a carga total negativa dos elétrons embutidos garante que o átomo, como um todo, não apresente carga líquida. Essa neutralidade é crucial para a estabilidade dos átomos e para a compreensão de suas interações com outros átomos.
O modelo explica a neutralidade elétrica como um equilíbrio entre as cargas opostas presentes no interior do átomo.
Representação Visual do Modelo Atômico de Thomson
Imagine uma esfera sólida de cor vermelha representando a carga elétrica positiva. Distribuídos aleatoriamente dentro dessa esfera vermelha, encontram-se pequenos pontos pretos, representando os elétrons, cada um com carga negativa. A quantidade de pontos pretos (elétrons) é igual à intensidade da cor vermelha (carga positiva), representando o equilíbrio e a neutralidade elétrica do átomo. A esfera vermelha não é uma representação precisa do tamanho ou da densidade da carga positiva, mas sim uma visualização simplificada da distribuição da carga no modelo de Thomson.
A distribuição dos elétrons também é uma simplificação, pois não indica a dinâmica ou as posições exatas dos elétrons dentro da esfera.
Evidências Experimentais que Levaram à Proposta do Modelo Atômico de Thomson
As principais evidências experimentais que levaram Thomson a propor seu modelo foram os resultados de seus experimentos com raios catódicos. Através desses experimentos, Thomson demonstrou a existência de partículas subatômicas carregadas negativamente, os elétrons. A descoberta de que os elétrons podiam ser extraídos de diferentes materiais, sugeria que eles eram constituintes universais da matéria. A observação de que os raios catódicos eram desviados por campos elétricos e magnéticos permitiu a Thomson determinar a razão entre a carga e a massa dos elétrons.
Essas descobertas foram fundamentais para a rejeição do modelo atômico de Dalton, que postulava a indivisibilidade do átomo, e para a construção de um novo modelo que incorporasse a existência de partículas subatômicas. A constatação da neutralidade elétrica da matéria, apesar da existência de elétrons carregados negativamente, levou Thomson a postular a existência de uma carga positiva para contrabalançar a carga negativa dos elétrons, culminando no modelo do “pudim de passas”.
Fundamentos e Implicações do Modelo Atômico de Thomson: Modelo Atômico De Thomson – Definição, Características E Fundamentos
O modelo atômico de Thomson, proposto em 1904, representou um avanço significativo na compreensão da estrutura da matéria, embora tenha sido posteriormente substituído por modelos mais precisos. Sua formulação se baseou em experimentos cruciais e teve implicações profundas para o desenvolvimento da física atômica. A análise de seus fundamentos e implicações permite uma melhor apreciação de sua contribuição para a ciência.
Experimentos que Contribuíram para o Modelo de Thomson
O desenvolvimento do modelo de Thomson foi fortemente influenciado por experimentos que investigavam a natureza da eletricidade e da matéria. Em particular, os estudos sobre raios catódicos foram fundamentais. Experimentos com tubos de raios catódicos demonstraram a existência de partículas carregadas negativamente, posteriormente denominadas elétrons. A independência da natureza dessas partículas em relação ao material do cátodo sugeria que os elétrons eram constituintes fundamentais de toda a matéria.
Thomson, através de experimentos com campos elétricos e magnéticos, conseguiu medir a relação carga-massa dos elétrons, fornecendo informações cruciais sobre suas propriedades. A descoberta da radioatividade, embora não diretamente relacionada à formulação do seu modelo, contribuiu para o entendimento da complexidade da estrutura atômica e reforçou a necessidade de modelos mais sofisticados.
Comparação entre os Modelos de Thomson e Rutherford
O modelo de Thomson, também conhecido como “modelo do pudim de passas”, propunha um átomo como uma esfera de carga positiva uniformemente distribuída, com elétrons incrustados nela, como passas em um pudim. Em contraste, o modelo de Rutherford, proposto posteriormente, descrevia o átomo como um núcleo pequeno, denso e carregado positivamente, ao redor do qual os elétrons orbitavam em espaços vazios.
A principal diferença reside na distribuição da carga: difusa e homogênea no modelo de Thomson, e concentrada no núcleo no modelo de Rutherford. O modelo de Rutherford, resultante de experimentos de espalhamento de partículas alfa, superou o modelo de Thomson ao explicar os resultados experimentais que este não conseguia justificar, como o espalhamento de grandes ângulos das partículas alfa.
Importância do Modelo de Thomson para a Compreensão da Estrutura Atômica

Apesar de suas limitações, o modelo atômico de Thomson foi crucial para o avanço da compreensão da estrutura atômica. Ele introduziu o conceito de que o átomo não era indivisível, mas sim composto por partículas menores, os elétrons, com carga negativa. Essa concepção revolucionária desafiou o modelo atômico anterior, que considerava o átomo como uma partícula sólida e indivisível.
A demonstração da existência de partículas subatômicas abriu caminho para investigações mais aprofundadas sobre a estrutura interna do átomo, preparando o terreno para os modelos atômicos posteriores, mais complexos e precisos.
Influência do Modelo de Thomson em Modelos Atômicos Posteriores
O modelo de Thomson, embora superado, serviu como base para modelos subsequentes. A ideia de que o átomo continha partículas carregadas negativamente (elétrons) foi mantida e incorporada em modelos posteriores, como o modelo de Rutherford e o modelo de Bohr. Embora a distribuição da carga e a estrutura espacial tenham sido revisadas, a descoberta dos elétrons e a sua inclusão na estrutura atômica, resultado direto do trabalho de Thomson, permaneceu como um conceito fundamental na física atômica.
O modelo serviu como um passo intermediário essencial na evolução do conhecimento sobre a estrutura atômica, demonstrando a natureza iterativa do processo científico.
Contribuições e Limitações do Modelo Atômico de Thomson
Antes de listar as contribuições e limitações, é importante destacar que o modelo de Thomson, apesar de suas falhas, foi um marco fundamental na história da física atômica. Sua simplicidade permitiu a visualização de um átomo estruturado, ainda que de forma simplificada.
- Contribuições: Introduziu o conceito de elétrons como partículas subatômicas; proporcionou uma primeira aproximação da estrutura atômica; estimulou novas pesquisas e modelos atômicos mais elaborados.
- Limitações: Não explicava a estabilidade do átomo; não conseguia explicar os resultados dos experimentos de espalhamento de partículas alfa; não levava em consideração a existência do núcleo atômico; não previa a existência de outras partículas subatômicas, como os prótons e nêutrons.
O modelo atômico de Thomson, apesar de suas limitações na explicação de fenômenos como a dispersão de partículas alfa, representou um avanço paradigmático na física. Sua analogia do “pudim de passas”, embora simplificada, introduziu o conceito crucial de carga elétrica dentro do átomo, pavimentando o caminho para modelos mais complexos e precisos. A análise comparativa com modelos anteriores, como o de Dalton, evidencia a evolução contínua da compreensão científica sobre a estrutura atômica, demonstrando como novas descobertas experimentais impulsionam a reformulação de teorias científicas estabelecidas.
A contribuição de Thomson permanece inegável na construção do conhecimento científico sobre a estrutura da matéria.

